NaOH + Cl2 → NaCl + NaClO + H2O là phản xạ lão hóa - khử. Bài ghi chép này hỗ trợ không thiếu vấn đề về phương trình chất hóa học đã và đang được cân đối, ĐK những hóa học nhập cuộc phản xạ, hiện tượng lạ (nếu có), ... Mời chúng ta đón xem:
Phản ứng: NaOH + Cl2 → NaCl + NaClO + H2O
Bạn đang xem: NaOH + Cl2 → NaCl + NaClO + H2O | NaOH ra NaCl | NaOH ra NaClO | Cl2 ra NaCl | Cl2 ra NaClO
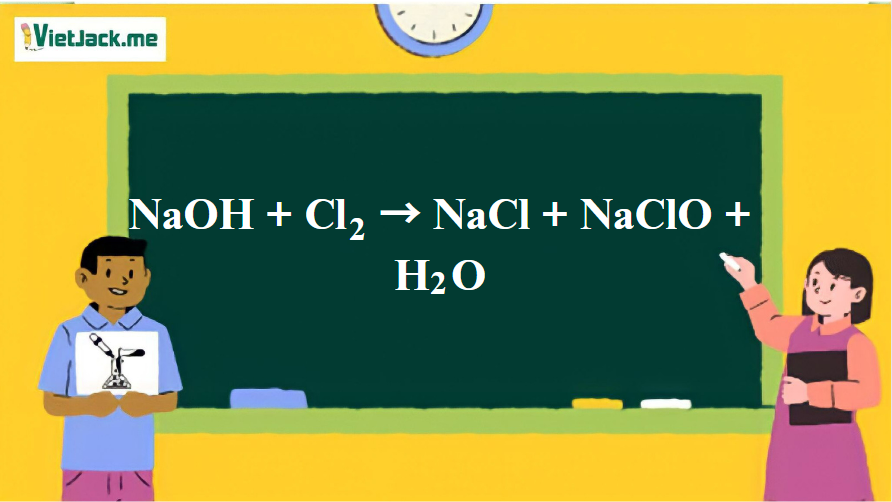
1. Phương trình phản xạ chất hóa học thân thiện NaOH và Cl2
2NaOH + Cl2 NaCl + NaClO + H2O
2. Điều khiếu nại phản ứng
- Phản ứng xẩy ra ngay lập tức ĐK thông thường.
3. Cách triển khai phản ứng
- Dẫn khí Cl2 vô ống thử chứa chấp hỗn hợp NaOH đem chứa chấp color quỳ tím.
4. Hiện tượng phân biệt phản ứng
- Ban đầu mẩu quỳ được màu xanh xao, sau khoản thời gian phản xạ xẩy ra color quỳ bị tổn thất.
5. Bản hóa học của những hóa học nhập cuộc phản ứng
5.1 Bản hóa học của NaOH
NaOH được dùng như 1 hóa học lão hóa nhằm lão hóa clo theo gót những phản xạ hoá học:
5.2 Bản hóa học của Cl2
- Trong phản xạ bên trên, Cl2 là hóa học bị oxi hóa
6. Tính hóa chất của NaOH
NaOH là một trong những bazơ mạnh nó sẽ bị thực hiện quỳ tím thay đổi màu xanh xao, còn hỗn hợp phenolphtalein trở nên color hồng. Một số phản xạ đặc thù của Natri Hidroxit được liệt kê ngay lập tức sau đây.
6.1 Phản ứng với axit tạo nên trở nên muối bột + nước:
NaOHdd + HCldd→ NaCldd + H2O
6.2 Phản ứng với oxit axit: SO2, CO2…
2NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
6.3 Phản ứng với axit cơ học tạo nên trở nên muối bột và thủy phân este, peptit:
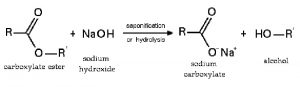
6.4 Phản ứng với muối bột tạo nên bazo mới mẻ + muối bột mới (điều kiện: sau phản xạ nên tạo nên trở nên hóa học kết tủa hoặc cất cánh hơi):
2NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
6.5 Tác dụng với sắt kẽm kim loại lưỡng tính:
2NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
6.6 Tác dụng với ăn ý hóa học lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
7. Tính hóa chất của Cl2
7.1. Tác dụng với kim loại
Đa số sắt kẽm kim loại và đem to nhằm khơi color phản xạ tạo nên muối bột clorua (có hoá trị cao nhất)
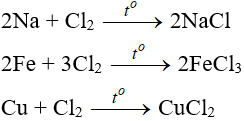
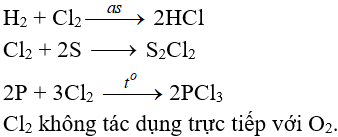
7.2. Tác dụng với phi kim
(cần đem sức nóng chừng hoặc đem ánh sáng)
7.3. Tác dụng với nước và hỗn hợp kiềm
Cl2 nhập cuộc phản xạ với tầm quan trọng vừa phải là hóa học lão hóa, vừa phải là hóa học khử.
Xem thêm: Cá heo thuộc lớp động vật nào?
Tác dụng với nuớc:
Khi hoà tan vô nước, một trong những phần Clo tính năng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ đem tính oxy hoá mạnh, nó đập phá hửy những color vì vậy nước clo hoặc clo độ ẩm đem tính tẩy color bởi.
Tác dụng với hỗn hợp bazơ:
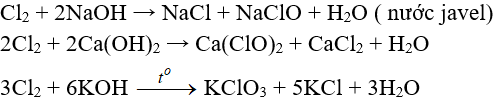
7.4. Tác dụng với muối bột của những halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
7.5. Tác dụng với hóa học khử khác
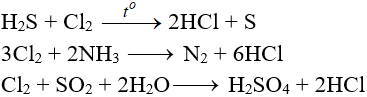
7.6. Phản ứng thế, phản xạ nằm trong, phản xạ phân huỷ với một số trong những ăn ý hóa học hữu cơ
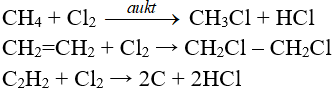
8. Tính hóa học vật lí của Cl2
Clo được màu vàng luc và lượng riêng biệt nặng trĩu rộng lớn bầu không khí. Clo đem kỹ năng tan vừa phải nên nội địa, tạo nên trở nên hỗn hợp nước Clo được màu vàng nhạt nhẽo. Hình như, Clo còn hoàn toàn có thể tan nhiều trong những dung môi cơ học. Cl2 là một trong những hóa học lão hóa mạnh, đơn giản và dễ dàng nhập cuộc nhiều phản xạ.
9. Quý khách hàng đem biết
- Phản ứng bên trên dung nhằm pha trộn nước gia – ven vô chống thực nghiệm.
- NaClO đem tính lão hóa mạnh, hoàn toàn có thể tẩy color và chi khử vi trùng.
10. Ví dụ minh họa
Ví dụ 1:
NaOH ko thể phản xạ với khí nào là sau?
A. SO2. B. CO2. C. Cl2. D. O2.
Hướng dẫn giải
NaOH ko thể phản xạ với O2.
Đáp án D.
Ví dụ 2:
Chất nào là tại đây đem tính tẩy màu?
A. KCl. B. NaCl. C. NaClO. D. MgCl2.
Hướng dẫn giải
NaClO đem tính lão hóa mạnh, hoàn toàn có thể tẩy color và chi khử vi trùng.
Đáp án C.
Ví dụ 3:
Phương pháp pha trộn nước gia – ven vô PTN là
A. mang đến khí clo tính năng với hỗn hợp NaOH ở sức nóng chừng thông thường.
B. mang đến khí clo tính năng với hỗn hợp NaOH ở 900C.
C. mang đến khí clo tính năng với nước ở sức nóng chừng thông thường.
D. năng lượng điện phân hỗn hợp NaCl đem màng ngăn.
Xem thêm: Không tìm được phương trình theo yêu cầu
Hướng dẫn giải
Phương pháp pha trộn nước gia – ven vô PTN là mang đến khí clo tính năng với hỗn hợp NaOH ở sức nóng chừng thông thường.
Đáp án A.
2NaOH + Cl2 → NaCl + NaClO + H2O