NaCl + H2SO4 → NaHSO4 + HCl là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng NaCl + H2SO4 NaHSO4 + HCl
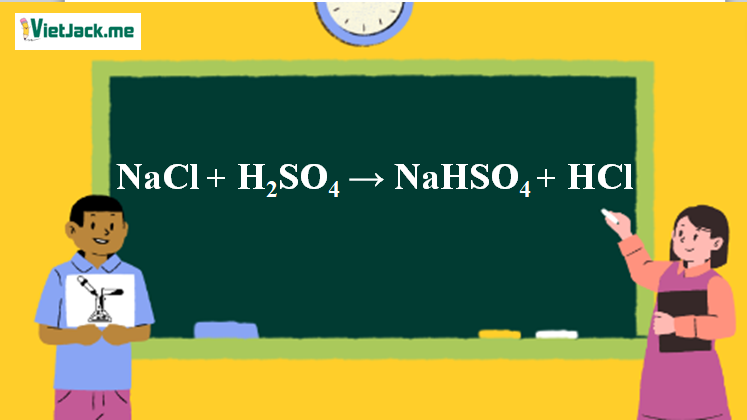
1. Phương trình phản ứng NaCl ra HCl
NaCl + H2SO4 NaHSO4 + HCl
2. Điều kiện phản ứng H2SO4 ra HCl
Nhiệt độ < 250oC
3. Cách tiến hành phản ứng NaCl tác dụng H2SO4 đặc
Cho tinh thể NaCl tác dụng với H2SO4đặc và đun nóng.
4. Tính chất hóa học của NaCl
Khác với các muối khác, NaCl không phản ứng với kim loại, axit, bazơ ở điều kiện thường. Tuy nhiên, NaCl vẫn phản ứng với một muối:
NaCl + AgNO3 → NaNO3 + AgCl↓
Ở trạng thái rắn, NaCl phản ứng với H2SO4 đậm đặc (phản ứng sản xuất HCl, nhưng hiện nay rất ít dùng vì phương pháp tạo ra nhiều khí độc hại, gây nguy hiểm tới hệ sinh thái, ô nhiễm môi trường).
NaCl + H2SO4 → NaHSO4+ HCl
2NaCl + H2SO4 → Na2SO4 + 2HCl
Điện phân dung dịch NaCl có màng ngăn xốp
2NaCl + 2H2O → 2NaOH + H2 + Cl2
5. Ứng dụng của NaCl
Trong nông nghiệp, chăn nuôi:
– Muối giúp cân bằng sinh lý trong cơ thể giúp gia súc, gia cầm phát triển khỏe mạnh, giảm bệnh tật.
– Giúp phân loại hạt giống theo trọng lượng
– Cung cấp thêm vi lượng khi trộn với các loại phân hữu cơ để tăng hiệu quả của phân bón.
Trong thực phẩm:
– Natri Clorua có tính hút ẩm, do đó được sử dụng để bảo quản thực phẩm, nó làm tăng áp suất thẩm thấu dẫn đến làm cho vi khuẩn bị mất nước và chết.
– Dùng muối để ướp thực phẩm sống như tôm, cá,…để không bị ươn, ôi trước khi thực phẩm được nấu.
– Khử mùi thực phẩm, giữ cho trái cây không bị thâm.
– Tăng hương vị, kiểm soát quá trình lên men của thực phẩm.
Trong y tế:
– Muối Natri Clorua dùng để sát trùng vết thương rất tốt.
– Dùng để trị cảm lạnh, pha huyết thanh, thuốc tiêu độc và một số loại thuốc khác để chữa bệnh cho con người.
– Cung cấp muối khoáng cho cơ thể thiếu nước.
– Muối có tác dụng khử độc, thanh lọc cơ thể, làm đẹp da, chữa viêm họng, làm trắng răng, chữa hôi miệng,…
Trong đời sống gia đình:
– Đuổi kiến
– Dập tắt lửa bùng cháy vì dầu mỡ
– Giữ nến khỏi chảy khi đốt
– Giữ cho hoa đã hái được tươi, hỗ trợ căm hoa giả
6. Tính chất hóa học của H2SO4
6.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
6.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
7. Bài tập vận dụng liên quan
Câu 1. Khí hidro clorua có thể được điều chế bằng cách cho muối ăn (NaCl rắn) tác dụng với chất nào sau đây?
A. H2SO4 loãng.
B. H2SO4 đặc.
C. NaOH đặc
D. H2O.
Lời giải
Đáp án: B
Khí HCl có thể được điều chế bằng cách cho tinh thể muối ăn tác dụng với axit H2SO4 đậm đặc
NaCl rắn + H2SO4 đặc → NaHSO4+ HCl
Câu 2. Dãy chất nào dưới đây phản ứng được với dung dịch H2SO4loãng
A. Cu, NaOH, KCl
B. Fe, KOH, BaCl2
C. Ag, NaOH, NaCl
D. Mg, KOH, SO2
Lời giải
Đáp án: B
Dãy chất nào dưới đây phản ứng được với dung dịch H2SO4 loãng
B. Fe, KOH, BaCl2
Fe + H2SO4→ FeSO4 + H2
2KOH + H2SO4→ K2SO4 + 2H2O
BaCl2 + H2SO4→ BaSO4 + 2HCl
Câu 3. Hòa tan hoàn toàn 2,55 gam hỗn hợp X gồm Fe, Mg và Zn bằng 1 lượng vừa đủ dung dịch H2SO4 loãng, thu được 2,24 lít khí hidro (đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 9,52
B. 10,27
C. 12,35
D. 12,15
Lời giải
Đáp án: D
nH2 = = 0,1 (mol) ⇒ nH2SO4 = nH2 = 0,1 mol
Bảo toàn khối lượng: 2,55 + 0,1.98 = m + 0,1.2
m = 12,15 gam
Câu 4. Phản ứng nào sau đây không đúng?
A. 2S + H2SO4 (đặc, nóng) → H2S + 2SO2
B. H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
C. H2S + O2 thiếu→ 2S + 2H2O
D. 2H2S + 3O2 dư → 2SO2 + 2H2O
Lời giải
Đáp án: A
A sai vì phản ứng đúng phải là
S + 2H2SO4 (đặc, nóng)→ 2H2O + 3SO2
Chú ý C và D đều đúng vì ở đây đã có điều kiện khi oxi thiếu và khi oxi dư thì sẽ có sản phẩm tạo ra tương ứng như trong phương trình phản ứng.
Câu 5. Để điều chế HCl trong công nghiệp, người ta sử dụng phương pháp:
A. clo hoá các hợp chất hữu cơ.
B. phương pháp tổng hợp.
C. phương pháp sunfat.
D. phương pháp khác.
Lời giải
Đáp án: B
Để điều chế HCl trong công nghiệp, người ta sử dụng phương pháp:
B. phương pháp tổng hợp.
Câu 6. Phản ứng dùng để điều chế HCl trong phòng thí nghiệm là:
A. H2 + Cl2 → HCl.
B. AgNO3+ HCl → AgCl + HNO3
C. NaCl(r) + H2SO4 (đ) → NaHSO4 + HCl.
D. BaCl2 + H2SO4 → BaSO4+ HCl.
Lời giải
Đáp án: C
Trong phòng thí nghiệm, người ta điều chế HCl bằng phương pháp cho NaCl tinh thể phản ứng với H2SO4đặc, nóng:
NaCl(r) + H2SO4 (đ) → NaHSO4 + HCl.
Câu 7. Dung dịch ZnSO4 có lẫn tạp chất là CuSO4. Dùng kim loại nào sau đây để làm sạch dung dịch ZnSO4?
A. Fe
B. Zn
C. Cu
D. Mg
Lời giải
Đáp án: B
Dùng kẽm vì có phản ứng:
Zn + CuSO4→ ZnSO4 + Cu ↓
Sau khi dùng dư Zn, Cu tạo thành không tan được tách ra khỏi dung dịch và thu được dung dịch ZnSO4 tinh khiết.
Không dùng Mg vì có phản ứng:
Mg + CuSO4 → MgSO4 + Cu ↓
Sau phản ứng có dd MgSO4 tạo thành, như vậy không tách được dung dịch ZnSO4 tinh khiết.
Câu 8. Dãy kim loại nào sau đây được sắp xếp đúng theo chiều hoạt động hóa học tăng dần?
A. K, Mg, Cu, Al, Zn, Fe.
B. Fe, Cu, K, Mg, Al, Zn.
C. Cu, Fe, Zn, Al, Mg, K.
D. Zn, K, Mg, Cu, Al, Fe.
Lời giải
Đáp án: C
Dựa vào dãy hoạt động của kim loại
Dãy kim loại được sắp xếp theo chiều hoạt động hóa học tăng dần là: Cu, Fe, Zn, Al, Mg, K
Câu 9. Nhận xét nào sau đây không đúng về H2SO4?
A. H2SO4 tan tốt trong nước
B. Ở điều kiện thường H2SO4 là chất rắn.
C. H2SO4 có tính axit mạnh.
D. H2SO4đặc có tính háo nước.
Lời giải
Đáp án: B
Câu 10. Phát biểu nào sau đây không đúng?
A. Axit sunfuric loãng có tính chất chung của axit mạnh.
B. Axit sunfuric đặc nóng có tính oxi hóa rất mạnh và hấp thụ nước mạnh.
C. Axit sunfuric là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp 2 lần nước.
D. Phải rót từ từ nước vào axit và khuấy nhẹ bằng đũa thủy tinh mà không được làm ngược lại.
Lời giải
Đáp án: D
Câu 11. Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3 hiện tượng xảy ra là
A. Có kết tủa keo trắng, sau đó kết tủa tan.
B. Chỉ có kết tủa keo trắng.
C. Có kết tủa keo trắng và khí bay lên.
D. Không có kết tủa, có khí bay lên.
Lời giải
Đáp án: A
Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3, ban đầu có kết tủa keo trắng xuất hiện.
3NaOH + AlCl3 → Al(OH)3 ↓ + 3NaCl
Sau đó kết tủa keo trắng tan trong NaOH dư tạo dung dịch trong suốt (vì Al(OH)3 có tính lưỡng tính tan được trong dung dịch axit dư, và kiềm dư)
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Câu 12. Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3. Hiện tượng quan sát được:
A. có kết tủa keo trắng tan dần đến hết.
B. có kết tủa keo trắng rồi tan, sau đó lại có kết tủa.
C. có kết tủa keo trắng, không thấy kết tủa tan.
D. dung dịch trong suốt.
Lời giải
Đáp án: C
Dẫn NH3 vào dung dịch AlCl3 có phản ứng hóa học sau:
AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
Vì NH3 là bazo yếu nên không thể hòa tan được hidroxit Al(OH)3
=> Hiện tượng: Có kết tủa keo trắng không tan
Xem thêm các phương trình hóa học khác:
NaHCO3 + Ca(OH)2 → CaCO3 + NaOH + H2O
NaHCO3 + Ba(OH)2 → BaCO3 + Na2CO3 + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
NaHCO3 + HCl → NaCl + CO2 + H2O
NaAlO2 + HCl + H2O → Al(OH)3 + NaCl